Fundamentos de Física
O que são processos
quase-estáticos, reversíveis e irreversíveis?
Vamos considerar um sistema qualquer que experimenta um processo espontâneo que o leva de um estado de equilíbrio a outro estado de equilíbrio. Como o processo é espontâneo, os estados intermediários não são, genericamente falando, estados de equilíbrio.
Se o processo é efetuado muito lentamente, desenvolvendo-se em etapas infinitesimais, o sistema tem tempo suficiente para atingir um estado de equilíbrio antes que uma nova perturbação aconteça. Nesse caso, dizemos que o processo é quase-estático. Nesse tipo de processo, o sistema se encontra, em qualquer instante de tempo, num estado de equilíbrio ou num estado muito próximo de um estado de equilíbrio. Assim, podemos considerar, com aproximação muito boa, que um processo quase-estático é constituído por uma sucessão de estados de equilíbrio.
O intervalo de tempo levado pelo sistema para voltar a um estado de equilíbrio quando submetido a uma pequena perturbação é chamado de tempo de relaxação. Usualmente, o tempo de relaxação é muito pequeno. Desse modo, para desenvolver na prática um processo que esteja muito próximo de um processo quase-estático é suficiente conduzir o sistema ao longo do processo com uma velocidade pequena comparada com a velocidade com que o sistema recobra o equilíbrio.
Se, além de ser quase-estático, o processo pode ser invertido por variações infinitesimais em qualquer propriedade do sistema, ele também é reversível. Em outras palavras, um processo é reversível se pode ser invertido, com o sistema passando pelos mesmos estados intermediários de equilíbrio, porém na ordem inversa.
Os processos reversíveis são importantes porque a energia cedida pelo sistema à vizinhança, por trabalho, numa expansão adiabática, é máxima quando o processo é reversível e inversamente, a energia recebida pelo sistema, por trabalho, da vizinhança, numa compressão adiabática, é mínima quando o processo é reversível.
Além disso, quando representamos um processo no diagrama , por exemplo, a cada ponto da curva corresponde um estado de equilíbrio do sistema. Estados que não são de equilíbrio não podem ser representados porque, para eles, não podemos definir nem temperatura nem pressão. Assim, apenas processos reversíveis podem ser representados nesse tipo de diagrama.
Por outro lado, no contexto da Termodinâmica, gás ideal é o modelo no qual as propriedades de qualquer estado de equilíbrio de um gás estão relacionadas pela equação de estado de Clapeyron:
para quaisquer valores de e . Nesta definição, representa a pressão, , o volume, , o número de mols, , a Constante Universal dos Gases e , a temperatura Kelvin do gás. Desse modo, só podemos usar esta equação de estado para determinar as propriedades de algum processo pelo qual passa um gás ideal quando este processo envolve apenas estados de equilíbrio, ou seja, quando o processo é reversível. O mesmo vale para qualquer outra substância da qual conhecemos a equação ou as equações de estado.
Para discutir concretamente os processos reversíveis e irreversíveis, vamos considerar, como exemplo, uma amostra de gás confinada em um cilindro com um pistão que pode se mover sem atrito. Além disso, vamos considerar que tanto o cilindro quanto o pistão estão termicamente isolados.
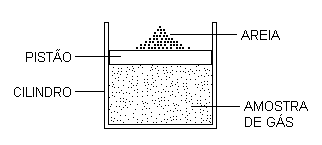
Podemos comprimir essa amostra de gás através de um processo quase-estático colocando grãos de areia sobre o pistão, um a um, lentamente. O processo resultante é reversível porque pode ser invertido se retirarmos os grãos de areia um a um, lentamente, na ordem inversa de sua colocação.
Se existe atrito entre o pistão e o cilindro, o pistão só pode ser colocado em movimento se adicionarmos certo número mínimo de grãos de areia de uma só vez porque, por assim dizer, o atrito prende o pistão ao cilindro. Nesse caso, o processo de compressão não pode ser quase-estático nem reversível.
O processo de transferência de energia por calor, de um corpo com certa temperatura para outro corpo com temperatura menor, é irreversível porque ocorre espontaneamente em um único sentido, do corpo com temperatura maior para o corpo com temperatura menor. Também é irreversível qualquer processo que converta energia mecânica em energia interna. Por exemplo, quando dois objetos em contato mútuo se movem um em relação ao outro, o atrito faz com que a energia mecânica se transforme em energia interna. Sabemos que essa transformação ocorre porque as temperaturas dos corpos aumentam. O processo inverso, isto é, a transformação do excesso de energia interna em energia mecânica, não pode ocorrer sem que a vizinhança dos corpos seja perturbada. Dessa forma, embora os corpos possam voltar à sua condição inicial, o processo é irreversível porque a vizinhança vai ficar num estado diferente do seu estado original.
Volte para Leis da Termodinâmica.
Site do Grupo de Ensino de Física da Universidade Federal de Santa Maria (GEF-UFSM)