Fundamentos de Física
Leis da Termodinâmica
A Termodinâmica estuda a troca de matéria e a troca de energia pelo trabalho e pelo calor entre sistemas ou entre um sistema e sua vizinhança. Trabalha com os estados de equilíbrio e com as propriedades macroscópicas que caracterizam os sistemas.
A Termodinâmica, como teoria Física, é estruturada por quatro leis: lei zero, associada ao conceito de temperatura, primeira lei, associada ao conceito de energia, segunda lei, associada ao conceito de entropia, e terceira lei, também chamada de postulado de Nernst, associada ao limite constante da entropia quando a temperatura Kelvin se apoxima de zero. Não abordaremos aqui esta última lei.
Aqui é importante frizar que utilizaremos os termos calor e trabalho para indicar processos:
- Calor é o processo de transferência de energia causado por uma diferença de temperatura.
- Trabalho é o processo mecânico de transferência de energia.
Lei Zero
Tomamos dois sistemas diferentes e colocamos um em contato com o outro através de uma parede imóvel, impermeável à passagem de matéria, mas que permita a passagem de energia por calor. A partir do momento em que as propriedades dos sistemas deixam de variar, eles terão alcançado o equilíbrio térmico.
A lei zero da Termodinâmica estabelece o seguinte: dois sistemas em equilíbrio térmico com um terceiro estão em equilíbrio térmico ente si.
Esta lei justifica o conceito de temperatura como sendo a propriedade que, sendo igual para dois sistemas, indica que estão em equilíbrio térmico.
Em termos práticos, para saber se dois sistemas têm a mesma temperatura não é necessário colocá-los em contato térmico entre si, bastando verificar se ambos estão em equilíbrio térmico com um terceiro corpo, chamado termômetro.
Dito de outra forma, consideremos que quando o sistema A está em equilíbrio térmico com o termômetro, ele indica a temperatura e quando o sistema B está em equilíbrio térmico com o mesmo termômetro, ele indica a temperatura . Então, se , os sistemas A e B estão em equilíbrio térmico um com o outro.
Primeira Lei
A energia interna de um sistema é a soma das energias cinéticas e das energias potenciais de todas as partículas que formam esse sistema e, como tal, é uma propriedade do sistema. Isto significa que qualquer variação na energia interna só depende do estado inicial e do estado final do sistema no processo considerado.
A primeira lei da Termodinâmica estabelece o seguinte: se um sistema troca energia com a vizinhança por calor e por trabalho, então a variação da sua energia interna é dada por:
Esta lei representa a aplicação do princípio de conservação da energia a sistemas termodinâmicos. representa a quantidade de energia transferida do sistema para a vizinhança por trabalho e representa a quantidade de energia transferida da vizinhança para o sistema por calor. Esta forma de escrever a variação da energia interna subentende uma convenção de sinal para e . Para esclarecer esta convenção de sinal, escrevemos a expressão acima na forma:
Agora fica mais fácil ver que:
- se , o sistema se expande e perde energia para a vizinhança e .
- se , o sistema se contrai e recebe energia da vizinhança e .
- se , a energia passa, por calor, da vizinhança para o sistema e .
- se , a energia passa, por calor, do sistema para a vizinhança e .
Embora só dependa do estado inicial e do estado final do sistema, porque representa a variação da sua energia interna, as quantidades de energia e dependem, também, do processo que leva o sistema do estado inicial ao estado final. Para discutir essa propriedade importante da energia interna vamos considerar uma amostra de gás que é levada do estado 1 para o estado 2 por três processos diferentes.
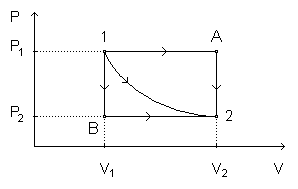
A quantidade de energia associada ao trabalho realizado pelo sistema sobre a vizinhança no processo 1-A-2 é dada pela área sob a isóbara 1-A, no processo 1-B-2 é dada pela área sob a isóbara B-2 e no processo 1-2 é dada pela área sob a curva correspondente. Por isso, a quantidade de energia associada ao trabalho depende do processo.
Por outro lado, se uma certa quantidade de energia entra no sistema por calor e a pressão do sistema permanece constante, uma parte da energia fica no sistema como energia interna, aumentando a sua temperatura, e a outra parte volta à vizinhança, pelo trabalho de expansão do sistema. Entretanto, se essa quantidade de energia associada ao calor entra no sistema e o volume do sistema permanece constante, não existe trabalho do sistema sobre a vizinhança e toda a energia fica no sistema como energia interna, causando um aumento maior na sua temperatura. Por isso, a quantidade de energia associada ao calor depende do processo.
A primeira lei afirma que, apesar da quantidade de energia trocada por trabalho e da quantidade de energia trocada por calor entre o sistema e a vizinhança dependerem, cada uma delas, do processo pelo qual o sistema passa de um estado para outro, a diferença não depende.
Segunda Lei
A primeira lei da Termodinâmica representa a aplicação do princípio de conservação da energia a sistemas que podem trocar energia com a vizinhança por calor. Esta lei, assim como o princípio de conservação da energia, não contém restrições quanto à direção do fluxo de energia entre dois sistemas. Por exemplo, estão de acordo com essa lei tanto a passagem de energia, por calor, de um corpo de temperatura maior a outro de temperatura menor, quanto a passagem de energia, por calor, de um corpo de temperatura menor a outro de temperatura maior. No entanto, na Natureza, observamos que é possível a passagem espontânea de energia por calor apenas de um corpo de temperatura maior a outro de temperatura menor. A segunda lei da Termodinâmica dá conta desta falta de simetria.
Vamos discutir, a seguir, dois enunciados equivalentes para a segunda lei da Termodinâmica. Estes enunciados são muito úteis nas discussões que envolvem máquinas térmicas e refrigeradores.
Enunciado de Kelvin: nenhum sistema pode realizar qualquer processo cíclico cujo único efeito seja retirar, por calor, certa quantidade de energia de um único reservatório térmico e ceder, por trabalho, uma quantidade igual de energia para a vizinhança.
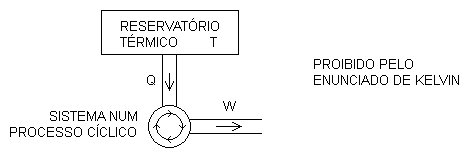
Aqui é muito importante observar que esse enunciado se refere a um processo cíclico. Podemos perfeitamente imaginar um processo não cíclico através do qual certa quantidade de energia é retirada, por calor, de um único reservatório térmico e uma quantidade igual de energia é devolvida, por trabalho, à vizinhança.
Como exemplo, podemos considerar uma amostra de gás ideal que se expande isotermicamente (isto é, a temperatura constante) em contato com um reservatório térmico. A amostra recebe energia, por calor, do reservatório térmico e, simultaneamente, cede energia, por trabalho, para a vizinhança. Nesse processo, e pela primeira lei, , isto é, a quantidade de energia recebida pelo gás por calor é igual à quantidade de energia cedida por trabalho.
Enunciado de Clausius: nenhum sistema pode realizar qualquer processo cíclico cujo único efeito seja retirar, por calor, certa quantidade de energia de um reservatório térmico com temperatura baixa e ceder, também por calor, igual quantidade de energia a um reservatório térmico com temperatura alta.
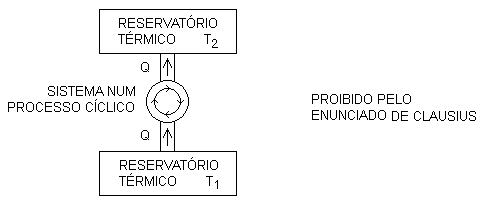
Aqui, novamente, é muito importante observar que esse enunciado se refere também a um processo cíclico. Se o sistema não volta ao estado inicial, a transferência de energia, por calor, do reservatório térmico com temperatura baixa para o reservatório térmico com temperatura alta é perfeitamente possível.
Como exemplo, podemos considerar uma amostra de gás ideal que é expandida isotermicamente em contato com um reservatório térmico de temperatura baixa (processo A-B), depois comprimida adiabaticamente (isto é, sem trocar energia por calor com a vizinhança), de modo que sua temperatura aumente de para (processo B-C) e, finalmente, comprimida isotermicamente em contato com um reservatório térmico de temperatura alta (processo C-D).
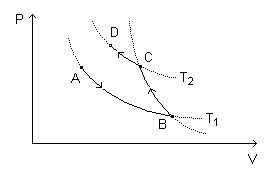
No processo A-B, o gás recebe do reservatório térmico de temperatura baixa certa quantidade de energia por calor e cede energia por trabalho. No processo B-C, o gás recebe energia por trabalho. No processo C-D, o gás cede certa quantidade de energia por calor ao reservatório térmico de temperatura alta e recebe energia por trabalho. De qualquer modo, podemos ajustar o processo global de modo que a quantidade de energia associada ao trabalho seja nula e, mesmo assim, uma certa quantidade de energia diferente de zero é transferida por calor do reservatório térmico de temperatura baixa para o reservatório térmico de temperatura alta.
Há um terceiro enunciado para a segunda lei da Termodinâmica baseado no conceito de entropia.
Enunciado pela Entropia: a entropia de um sistema isolado não se altera se ele realiza um processo reversível e aumenta se ele realiza um processo irreversível.
Um sistema isolado não troca energia e não troca matéria com a vizinhança.
De modo geral, os processos naturais são espontâneos e, portanto, não são quase-estáticos. Isto significa que eles são irreversíveis e ocorrem, sempre, com aumento de entropia. Assim, a entropia do universo aumenta sempre.
O aumento da entropia em processos irreversíveis é muito importante para dar sentido ao próprio conceito de entropia.
A energia e a entropia de um sistema isolado não variam se o sistema evolui reversivelmente. Por definição, os estados do sistema, associados a qualquer processo reversível, são estados de equilíbrio termodinâmico. Além disso, leva um certo intervalo de tempo para que o sistema, uma vez perturbado, atinja um novo estado de equilíbrio termodinâmico. Desta forma, um processo só pode ser completamente reversível caso se desenvolva muito lentamente. Os processos naturais não são reversíveis justamente por isso.
Por outro lado, a energia se conserva e a entropia sempre aumenta nos processos irreversíveis que ocorrem num sistema isolado. A propriedade de conservação da energia, sendo inerente a um sistema isolado, quaisquer que sejam os processos, reversíveis ou não, pelos quais ele passa, mostra que a energia não pode indicar o sentido da evolução de tais processos. Contudo, o aumento da entropia nos processos irreversíveis, aumento esse também inerente a um sistema isolado, mostra que a entropia pode indicar, sim, o sentido da evolução de tais processos: o estado inicial pode ser diferenciado do estado final porque este último tem, necessariamente, maior entropia.
Leia mais... O Ponto de Vista Estatístico
Leia mais... Teoria Cinética e Termodinâmica
Site do Grupo de Ensino de Física da Universidade Federal de Santa Maria (GEF-UFSM)