Fundamentos de Física
Como se caracteriza o ciclo de Carnot?
O ciclo de Carnot é o ciclo reversível constituído por dois processos isotérmicos, A-B e C-D, e dois processos adiabáticos, B-C e D-A. A figura representa um ciclo de Carnot com uma amostra de gás ideal por questões didáticas. Qualquer substância pode ser levada a executar um ciclo de Carnot.
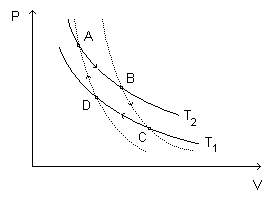
Para discutir o ciclo de Carnot, vamos considerar que ele é percorrido pelo sistema no sentido indicado na figura.
- Processo A-B: Expansão isotérmica, temperatura constante. O sistema recebe a quantidade de energia por calor de um reservatório térmico na temperatura e entrega a quantidade de energia por trabalho para a vizinhança.
- Processo B-C: Expansão adiabática, temperatura cai de para . O sistema não troca energia por calor, mas entrega a quantidade de energia por trabalho para a vizinhança.
- Processo C-D: Compressão isotérmica, temperatura constante. O sistema entrega a quantidade de energia por calor a um reservatório térmico na temperatura e recebe a quantidade de energia por trabalho da vizinhança.
- Processo D-A: Compressão adiabática, temperatura aumenta de para . O sistema não troca energia por calor, mas recebe a quantidade de energia por trabalho da vizinhança.
Assim, com o ciclo percorrido no sentido indicado na figura, o sistema ganha (ou retira) a quantidade de energia de um reservatório térmico na temperatura e perde (ou cede) a quantidade de energia para um reservatório térmico na temperatura .
Como a energia interna é função de estado, para um ciclo completo devemos ter . Portanto, pela primeira lei da Termodinâmica:
em que é a quantidade de energia total associada ao trabalho do sistema sobre a vizinhança e é a quantidade de energia total associada ao calor da vizinhança para o sistema:
eComo estamos considerando o ciclo de Carnot percorrido pelo sistema no sentido indicado na figura, as quantidades , e são positivas e as quantidades , e são negativas.
No caso em que o sistema que realiza o ciclo de Carnot é formado por uma amostra de gás ideal e as temperaturas e são dadas na escala Kelvin, temos (sem demonstração), entre outros resultados, que:
[Gás Ideal]
As temperaturas Kelvin e são positivas. Portanto, o lado esquerdo da igualdade é positivo. Como estamos considerando o ciclo de Carnot percorrido pelo sistema no sentido indicado na figura, a quantidade é positiva e a quantidade é negativa. Portanto, o lado direito da igualdade também é positivo.
Volte para Leis da Termodinâmica.
Site do Grupo de Ensino de Física da Universidade Federal de Santa Maria (GEF-UFSM)