Fundamentos de Física
Por que a energia interna de um gás ideal
só depende da temperatura?
A energia interna de uma dada amostra de gás ideal é função apenas da temperatura absoluta. Vamos discutir esta propriedade por meio de um experimento de expansão livre.
Dois recipientes, A e B, são conectados com uma válvula fechada. No recipiente A existe certa quantidade de gás real a pressão e no recipiente B, vácuo. Ambos estão em um banho térmico, ou seja, mergulhados numa grande quantidade de água isolada do resto do universo a temperatura T e em equilíbrio com ela.
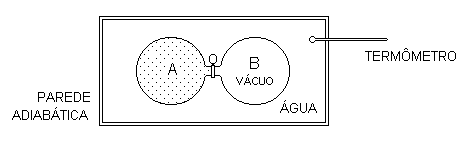
Quando abrimos a válvula, a amostra de gás do recipiente A se expande pelo recipiente B, contra uma pressão externa zero. Por isso, o processo é chamado expansão livre.
A quantidade de energia associada ao trabalho da amostra de gás contra a vizinhança é zero porque a pressão da vizinhança é zero.
Por outro lado, medindo a temperatura da amostra de gás quando ela ocupa os dois recipientes e alcança o equilíbrio, verificamos que essa temperatura final é um pouco maior do que a temperatura inicial.
Repetindo o experimento com quantidades cada vez menores de gás, isto é, com gás a pressão cada vez menor, observamos que o aumento de temperatura também fica cada vez menor. Como, no limite em que sua pressão é muito baixa, um gás real se comporta como um gás ideal, podemos considerar que, para gases ideais, o processo de expansão livre não é acompanhado de variação de temperatura, ou seja, é isotérmico. Portanto, não há fluxo de energia associada ao calor entre a amostra de gás ideal e a vizinhança.
Desta maneira, sendo e , temos, pela primeira lei da Termodinâmica, que .
No processo, a amostra de gás teve uma expansão, isto é, uma variação de volume não nula e, mesmo assim, a sua energia interna permaneceu constante. Então, devemos concluir que a energia interna de uma amostra de gás ideal não depende do volume.
As propriedades (pressão), (volume), (temperatura absoluta) e (número de mols) de uma amostra de gás ideal em um estado de equilíbrio estão relacionadas pela equação de estado de Clapeyron:
Como estamos considerando constante, isso significa que apenas duas daquelas propriedades são independentes: e , e ou e . Conforme a situação, qualquer um desses pares pode ser escolhido para representar os estados de equilíbrio da amostra e qualquer outra propriedade da amostra pode ser expressa como função do par escolhido.
Sendo assim, escolhemos, agora, considerar a energia interna da amostra de gás ideal como função de e . Contudo, concluímos, logo acima, que a energia interna de uma amostra de gás ideal não depende do seu volume. Portanto, a energia interna de uma amostra de gás ideal só depende da sua temperatura.
Volte para Leis da Termodinâmica.
Site do Grupo de Ensino de Física da Universidade Federal de Santa Maria (GEF-UFSM)