Fundamentos de Física
O que é o termômetro de gás a volume constante?
Num termômetro de gás a volume constante, uma amostra de gás enche um bulbo e um capilar ligado a um manômetro de tubo aberto com mercúrio. O bulbo é colocado em contato térmico com o sistema cuja temperatura queremos determinar. Um tubo flexível permite levantar ou abaixar um reservatório com mercúrio, fazendo com que a superfície do mercúrio no ramo esquerdo do manômetro coincida sempre com o zero da escala. Assim, podemos manter constante o volume da amostra de gás, apesar do aumento ou diminuição da sua temperatura.
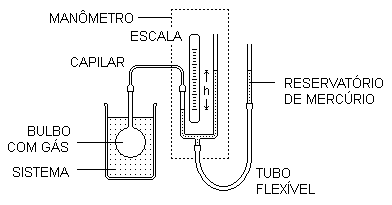
Neste termômetro, a propriedade termométrica é a pressão da amostra de gás no bulbo. Podemos determinar essa pressão pela lei de Stevin:
em que é a pressão atmosférica, é a densidade do mercúrio, é o módulo da aceleração da gravidade e é o desnível do mercúrio que medimos na escala do manômetro.
Se o gás no bulbo se comporta como gás ideal, podemos relacionar sua pressão com sua temperatura pela equação de Clapeyron:
Nesta expressão, escrevemos porque a temperatura do gás no bulbo depende da pressão.
O ponto triplo da água é um estado bem definido, em que as três fases (líquida, sólida e vapor) coexistem em equilíbrio a uma temperatura de 0,01 ∘C ou 273,16 K.
A escala associada ao termômetro que estamos discutindo tem um único ponto fixo, definido em função do ponto triplo da água pela relação:
- Tt ≡ 273,16 K
Se o gás no bulbo tem a temperatura do ponto triplo da água, podemos escrever, pela equação de Clapeyron:
Desta forma, comparando as duas expressões provenientes da equação de Clapeyron, obtemos:
e tomamos a temperatura assim definida como sendo a temperatura da amostra de gás no bulbo e também a temperatura do sistema.
Na prática, medimos (colocando o bulbo de gás em contato térmico com água no ponto triplo) e (colocando o bulbo de gás em contato térmico com o sistema cuja temperatura desejamos determinar) para amostras de gás cada vez mais rarefeitas e tomamos a temperatura da amostra de gás no bulbo e do sistema como sendo o resultado desse processo de limite.
Como os gases reais se comportam como gases ideais no limite de baixas pressões, esta escala é chamada escala termométrica de gás ideal.
Esta escala de temperatura é independente de qualquer propriedade de qualquer gás em particular, mas depende das propriedades dos gases ideais. A escala termométrica Kelvin é independente de qualquer propriedade de qualquer substância e, por isso, é uma escala absoluta. De qualquer modo, a escala Kelvin e a escala de gás ideal são idênticas no intervalo de temperatura em que o termômetro de gás a volume constante pode ser usado.
Volte para Leis da Termodinâmica.
Site do Grupo de Ensino de Física da Universidade Federal de Santa Maria (GEF-UFSM)