Fundamentos de Física
Princípio de Exclusão de Pauli
Para que o conceito de órbita tenha sentido em escala atômica, devemos ser capazes de determinar, para qualquer posição do elétron, a correspondente velocidade instantânea. Contudo, de acordo com o princípio de incerteza de Heisenberg, não podemos determinar simultaneamente, com precisão arbitrária, a posição e o momentum (produto da massa pela velocidade) de uma partícula. Desse modo, não podemos, como estabelece o modelo atômico de Bohr, estender o conceito de órbita a sistemas atômicos.
Além dessa dificuldade, o modelo atômico de Bohr tem outras limitações. Não há justificativa para o postulado dos estados estacionários e para o postulado de quantização do momentum angular. O modelo não prevê a intensidade das raias espectrais e não pode ser estendido para átomos com mais de um elétron. Essas dificuldades são resolvidas pela Mecânica Quântica.
Na formulação de Schrödinger da Mecânica Quântica, as informações que podemos obter sobre um dado sistema estão contidas numa função matemática chamada função de onda. Para encontrar a função de onda de um dado sistema, temos que resolver uma equação diferencial conhecida como Equação de Schrödinger. Não vamos, aqui, resolver a equação de Schrödinger para átomos com um elétron, mas informaremos os principais resultados.
O módulo da função de onda ao quadrado está associado a distribuições de probabilidade de encontrar o elétron no espaço ao redor do núcleo atômico. Essas distribuições de probabilidade são caracterizadas por três números quânticos: , e .
Associada a cada uma dessas distribuições de probabilidade, existe uma região do espaço chamada orbital, dentro da qual a probabilidade de encontrar o elétron é de 90%.
O número quântico principal está associado à probabilidade de encontrar o elétron a certa distância do núcleo e define a camada eletrônica em que se encontra o elétron: , primeira camada, , segunda camada, , terceira camada, e assim por diante.
As energias permitidas para um átomo com um elétron são dadas por uma expressão idêntica àquela obtida no modelo de Bohr:
[, , , ... ]
O número quântico orbital está associado ao módulo do momentum angular orbital do elétron pela relação:
em que é a constante de Planck dividida por . Os valores possíveis para esse número quântico são:
, , , ...
Assim, para só podemos ter . Para podemos ter e . E assim por diante.
O número quântico magnético está associado à componente do momentum angular orbital do elétron ao longo de um dado eixo do referencial, que podemos tomar como sendo o eixo . Sendo assim, temos:
Os valores possíveis para esse número quântico são:
, , , ...
Por exemplo, para (figura (a)), temos:
e
, , , ,
Isto significa que, para , o vetor momentum angular orbital do elétron só pode ter orientações no espaço, uma para cada valor de .
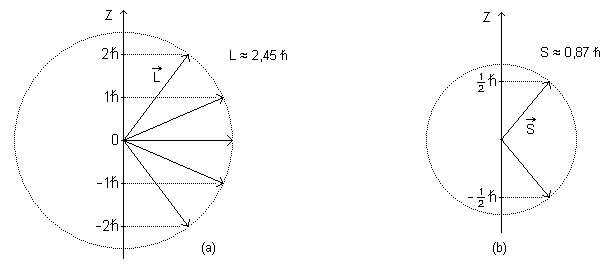
Independentemente de estar ou não ligado a um átomo, o elétron tem um momentum angular intrínseco, chamado de spin. Como no caso do momentum angular orbital, escrevemos, para o módulo do spin:
O número quântico de spin está associado à componente do spin do elétron ao longo do eixo . Assim:
Os valores possíveis para esse número quântico são:
e, por isso, e (figura (b)). Dizemos que o elétron tem spin “para cima” quando e dizemos que o elétron tem spin “para baixo” quando .
Como dissemos acima, os orbitais de um átomo com um elétron são caracterizados pelos três números quânticos: , e . As energias associadas aos orbitais só dependem do número quântico .
A cada conjunto de valores para os números quânticos , , e está associado um estado estacionário do átomo com um elétron.
Agora, para aplicar isto que foi descrito acima para átomos com mais de um elétron, usamos a aproximação de partículas independentes. Nesta aproximação, consideramos cada elétron como se movendo sob o efeito de uma força atrativa devido ao núcleo atômico e de uma força repulsiva média devida a todos os outros elétrons do átomo.
Como antes, os orbitais são caracterizados pelos três números quânticos , e e os estados dos elétrons são caracterizados pelos quatro números quânticos , , e . As energias associadas aos orbitais dependem, agora, dos números quânticos e . A energia do átomo é a soma das energias associadas aos elétrons em seus orbitais.
Por outro lado, segundo o princípio de exclusão de Pauli: não pode haver, em um átomo, mais de um elétron com um dado conjunto de valores para os números quânticos , , e .
Isto significa que, em cada orbital podem existir até dois elétrons, um com spin “para cima” e outro com spin “para baixo”.
Para saber a distribuição dos elétrons de um átomo em termos energéticos podemos usar o diagrama da figura.
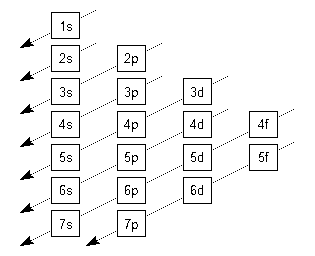
Nesta figura, o número dentro de cada quadrado é o valor de . Assim, cada linha do diagrama corresponde a uma camada eletrônica.
A letra representa o valor de :
As setas da figura indicam a ordem com que os elétrons devem ser distribuidos, iniciando pelo topo.
Devemos observar que até dois elétrons podem ocupar o mesmo orbital, um com spin "para cima" e outro com spin "para baixo". Além disso:
- corresponde a um orbital ()
- corresponde a três orbitais (, )
- corresponde a cinco orbitais (, , )
- corresponde a sete orbitais (, , , )
Para ilustrar o procedimento, consideremos o átomo de germânio com 32 elétrons. A distribuição eletrônica é:
Ge:
Os expoentes representam os números de elétrons. Em , embora sejam permitidos 6 elétrons, só existem 2. As três primeiras camadas ( 1, 2 e 3) estão completas. Há uma interpenetração das camadas 3 e 4 porque vem antes de .
Site do Grupo de Ensino de Física da Universidade Federal de Santa Maria (GEF-UFSM)