Fundamentos de Física
O que é o modelo de Bohr?
O modelo atômico de Bohr foi uma tentativa de aplicar as idéias de quantização de Planck e Einstein ao modelo nuclear de Rutherford. Com o referencial fixo no núcleo do átomo, o modelo está baseado nas seguintes hipóteses:
- O movimento do elétron ao redor do núcleo atômico é descrito pelas leis de Newton.
- O elétron pode ocupar apenas certas órbitas especiais ao redor do núcleo. Estas órbitas são determinadas impondo que o módulo do momentum angular do elétron ao redor do núcleo só pode ter valores múltiplos inteiros da constante de Planck dividida por :
[] - As órbitas são estacionárias. Os estados atômicos correspondentes são estados estacionários.
- O átomo pode passar de um estado estacionário para outro por emissão ou absorção de radiação eletromagnética com freqüência dada por:
em que é o módulo da diferença de energia entre os estados estacionários.
A primeira suposição não apresenta qualquer problema de aceitação e estipula, apesar das outras características estranhas do modelo, um comportamento newtoniano clássico usual para o elétron nas órbitas estacionárias. A segunda suposição não tem qualquer justificativa a não ser o sucesso do modelo. A terceira suposição aparece para evitar o dilema da emissão de radiação eletromagnética pelo elétron no seu movimento acelerado ao redor do núcleo, que levaria ao colapso do átomo. A quarta suposição é a mais estranha para a Física Clássica porque não especifica o mecanismo de passagem do elétron de uma órbita estacionária para outra.
Vamos discutir os raios das órbitas possíveis para o elétron e as correspondentes energias dos estados estacionários do átomo.
Consideremos um átomo com número atômico , formado por um núcleo com carga positiva e um elétron com massa e carga elétrica . Num referencial inercial fixo no núcleo, o elétron tem uma órbita circular. Igualando o módulo da força centrípeta ao módulo da força eletrostática que atua sobre o elétron, temos:
em que representa o módulo da velocidade do elétron e , o raio da sua órbita.
O módulo do momentum angular de um elétron de massa , numa órbita circular de raio ao redor do núcleo, é dado pela expressão:
No modelo de Bohr, o módulo do momentum angular do elétron numa órbita estacionária deve ter valores múltiplos inteiros de . Portanto, podemos escrever, para a -ésima órbita:
[]
O número inteiro , que especifica a órbita ou o estado estacionário do átomo, é chamado de número quântico.
Isolando nesta expressão e substituindo na anterior, obtemos:
[]
Segundo o modelo de Bohr, as únicas órbitas possíveis para o elétron que gira ao redor do núcleo são aquelas com raios dados por essa expressão.
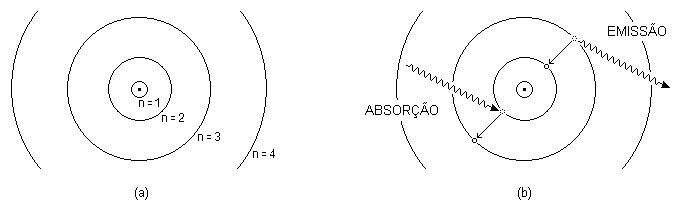
A figura (a) representa as primeiras órbitas com os raios em escala. A figura (b) ilustra os processos de emissão e absorção de radiação eletromagnética pelo átomo.
Por outro lado, como o referencial está fixo no núcleo atômico, ele tem velocidade nula. Desse modo, a energia cinética do átomo é a energia cinética do elétron. Se o elétron se move na -ésima órbita:
Nesse contexto, é conveniente tomar a energia potencial atômica como sendo nula quando o elétron está a uma distância infinita do núcleo. Assim, a energia potencial do átomo, quando o elétron está na -ésima órbita fica:
e levando em conta a expressão demonstrada acima para , a energia total do átomo de um elétron, num referencial fixo no núcleo, quando o elétron está na -ésima órbita, pode ser escrita:
[, , , ... ]
Segundo o modelo de Bohr, estas são as energias possíveis para o átomo, associadas às órbitas possíveis para o elétron que gira ao redor do núcleo.
O modelo atômico de Bohr é um modelo semi-clássico porque envolve tanto conceitos da Física Clássica quanto conceitos da Física Quântica. Num modelo puramente quântico, não podemos falar em uma energia bem definida para cada órbita e também não podemos falar em órbitas para os elétrons ao redor do núcleo atômico.
Volte para Princípio de Exclusão de Pauli.
Site do Grupo de Ensino de Física da Universidade Federal de Santa Maria (GEF-UFSM)